肿瘤的靶向治疗是指针对特定的致癌靶点或者激活通路设计小分子抑制剂或者抗体,通过特异性抑制这些激活靶点的生物学功能来达到杀伤肿瘤细胞的目的。然而,由于癌细胞的基因不稳定性或者信号通路网之间的代偿性激活,肿瘤常常对靶向药物产生耐受,继而复发。在众多癌症中,恶性黑色素瘤的耐药问题已经严重影响了黑色素瘤靶向治疗的临床效果。我们课题组在Molecular Biomedicine上发表了题为“Integrin-Src-YAP1 signaling mediates the melanoma acquired resistance to MAPK and PI3K/mTOR dual targeted therapy”的研究成果[1],首次发现,整合素(Integrin)通路的激活是黑色素瘤患者对双靶向MAPK和PI3K/mTOR通路治疗产生耐药性的关键,揭示了Integrin-Src-YAP1通路参与黑色素瘤MAPKi和PI3K/mTORi双药耐药调控机制,并为双药耐药黑色素瘤治疗提供了潜在的治疗靶点。
恶性黑色素瘤是一种常见的皮肤恶性肿瘤[2],约50-60%的黑色素瘤中BRAF基因发生了突变,并导致下游MEK-ERK信号通路持续激活, 这一过程对肿瘤的生长增殖和侵袭转移至关重要, 使BRAF成为治疗黑色素瘤最主要的作用靶标之一。靶向BRAF(V600E) 突变的抑制剂vemurafenib(PLX4032)用于治疗晚期黑色素患者,但随后几乎所有病人都产生了耐药并复发,目前临床亟需解决黑色素瘤的耐药问题。
我们课题组深耕MAPK通路多年,发现MAPK和PI3K-AKT-mTOR双通路的激活是BRAF抑制剂单药耐药的主要原因。相关的体内外研究显示,同时靶向这两条信号通路能显著抑制肿瘤细胞的生长[3, 4]。然而,令人遗憾的是,虽然靶向联合治疗前景良好,但最终会仍出现耐药现象。因此,本研究深入探索了黑色素瘤MAPKi和PI3K/mTORi双药耐药机理,期待为合理的联合治疗提供新思路。
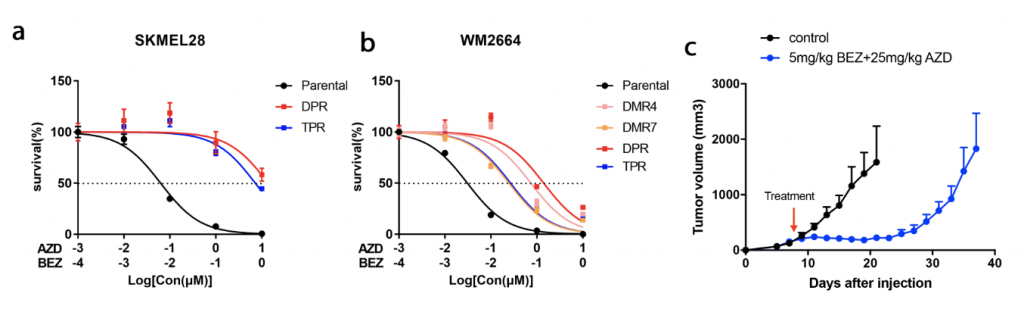
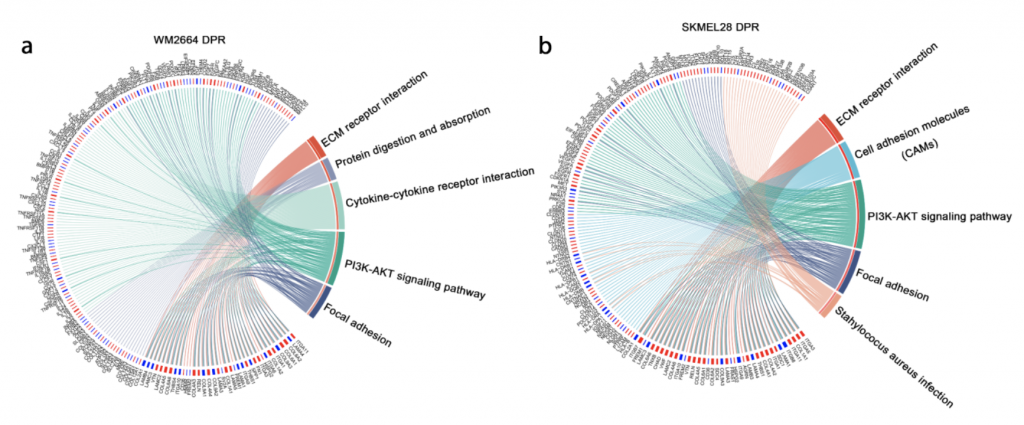
首先建立了体内外双药耐药模型 (图1),通过该模型验证了黑色素瘤双药耐药细胞中代偿通路的激活。而后,GO以及KEGG通路富集分析发现细胞外基质(ECM)受体互作通路(ECM-receptor interaction pathway)显著富集(图2)。并且,整合素家族基因(integrins)作为一种ECM受体,在耐药细胞系中的表达显著提高,说明该基因参与的通路被异常激活。
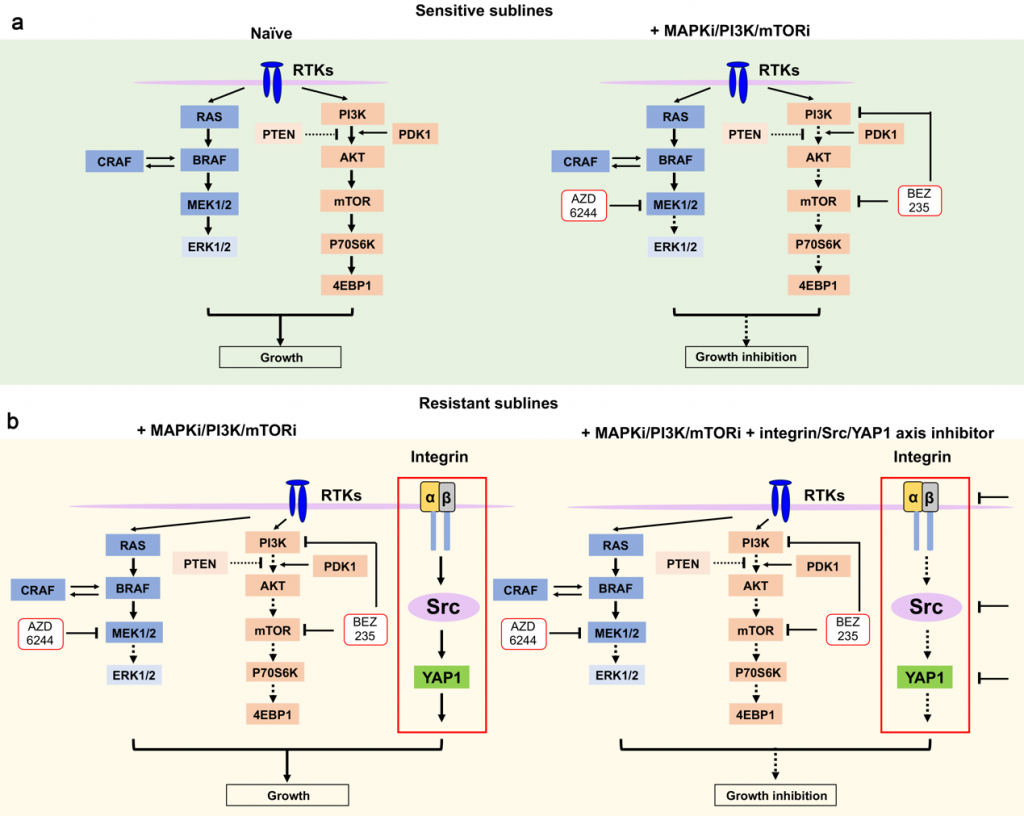
然而,这些整合素是如何发挥功能的呢?我们首先聚焦到整合素下游激酶Src和Fak。利用慢病毒介导的表达干预技术敲除这些基因后,发现Src是整合素的调控靶点。同时,在整合素的其他调控通路的探索中,发现TGFβ, WNT, 和 NF-κB通路都没有参与双药耐药过程,而通过对一系列Src的靶基因进行功能验证,发现Src是通过调控LATS 和 YAP1的去磷酸化入核来发挥其生物学功能。
总体而言,本研究系统阐明了整合素调控黑色素瘤细胞双药耐药细胞中ECM受体互作通路激活的分子机理,并为双药耐药黑色素瘤治疗提供了潜在的治疗靶点(图3)。这为解决黑色素瘤耐药性的难题提供了新的方向。不过,尽管目前发现Src的抑制使黑色素瘤细胞对MEKi和PI3K/mTORi敏感,Src家族的其他成员是否参与了对双途径抑制的抵抗还需要进一步的研究。
原文链接:https://link.springer.com/article/10.1186/s43556-020-00013-0
参考文献:
[1] Yu C, Zhang M, Song J, Zheng X, Xu G, Bao Y, et al. Integrin-Src-YAP1 signaling mediates the melanoma acquired resistance to MAPK and PI3K/mTOR dual targeted therapy. Mol Biomed. 2020;1(1):12.https://doi.org/10.1186/s43556-020-00013-0
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30.
[3] Roberts PJ, Usary JE, Darr DB, Dillon PM, Pfefferle AD, Whittle MC, et al. Combined PI3K/mTOR and MEK inhibition provides broad antitumor activity in faithful murine cancer models. Clin Cancer Res. 2012;18(19):5290-303.
[4] Shi H, Kong X, Ribas A, Lo RS. Combinatorial treatments that overcome PDGFRβ-driven resistance of melanoma cells to V600EB-RAF inhibition. Cancer Res. 2011;71(15):5067-74.
供稿:余春娥
编辑:余静