恶性黑色素瘤是一类高复发、高转移的皮肤肿瘤,对术后辅助放、化疗不敏感,预后较差。约60%黑色素瘤含V600EBRAF突变,该突变导致MAPK通路过度激活,促进肿瘤生长与转移。针对V600EBRAF突变及下游激活的MEK1/2激酶所设计的靶向药物如维罗非尼(vemurafenib,靶向V600EBRAF)、曲美替尼(trametinib,靶向MEK1/2)单独及联合用药将黑色素瘤的有效率提高到48%和76%,已被广泛用于黑色素瘤的一线治疗,但存在严重的耐药复发问题。因此,长期有效的抗肿瘤策略在治疗肿瘤中是迫切需要的。
近年来,随着肿瘤免疫逃逸机制研究的不断深入,以程序性死亡蛋白1 (programed cell death 1,PD-1)及其配体(programed cell death-ligand 1, PD-L1)为靶点的免疫检测点抑制剂在黑色素瘤临床治疗中取得了显著的进展,显著延长了患者的生存期。然而,anti-PD-1/PD-L1免疫治疗仍然存在严峻的临床瓶颈问题,即响应率低(黑色素瘤中响应率仅为10%-40%)。研究表明,anti-PD-1/PD-L1免疫治疗联合MAPK靶向治疗是一项非常具有潜力的抗肿瘤策略,其不仅在分子机理上有理论可行性,且在疗效上具有优劣势互补的特点,是目前探索治疗黑色素瘤等恶性肿瘤的主要研究方向和治疗策略之一,目前有大量该联合疗法的临床试验正在开展。2020年4月AACR年会中罗氏公司公布的IMspire150试验(BRAFi + MEKi + anti-PD-L1)的成功进一步说明了靶向治疗联合免疫治疗用于晚期黑色素瘤临床治疗的前景。然而,2020年8月诺华公司公布的COMBI-iIII期临床试验(NCT02967692)中,联合治疗方案(BRAFi + MEKi + anti-PD-1)与单药治疗相比未能显著提高患者的无进展生存期(PFS)。此外,研究发现MAPK靶向治疗耐药的黑色素瘤患者几乎对anti-PD-1/PD-L1免疫治疗不响应。因此,迫切希望找出这一悖论背后的潜在机制,并找到可协同anti-PD-1/PD-L1免疫治疗与MAPK靶向治疗的新方法。
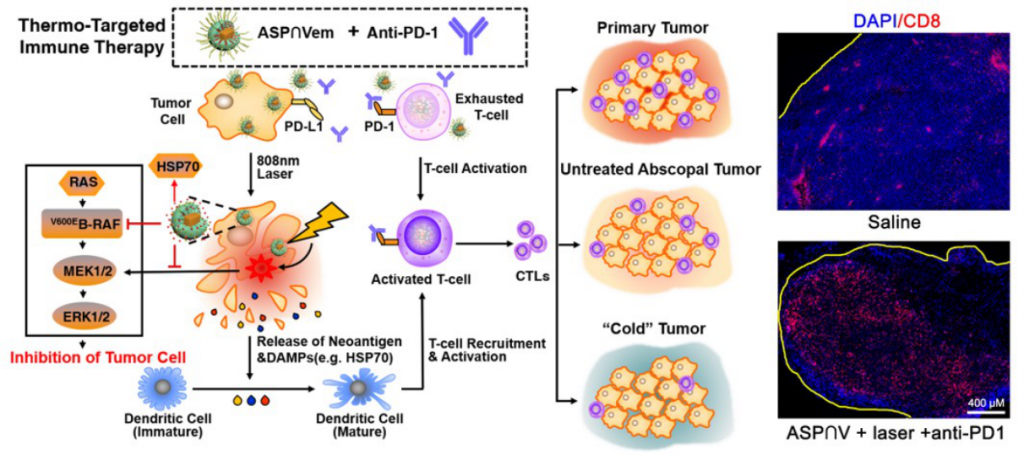
四川大学石虎兵教授研究团队联合中国科学院长春应用化学研究所张海元教授研究团队在黑色素瘤患者和小鼠模型中,发现MAPK靶向治疗耐药导致热休克蛋白HSP70/HSP27介导的第三类抗原递呈不足,使肿瘤微环境免疫细胞浸润不足,阻碍了anti-PD-1免疫治疗的疗效(图1)。为了恢复肿瘤微环境T细胞的浸润,研究者通过光热介导的高温促进肿瘤细胞免疫原性坏死(ICD)的发生和HSP蛋白的表达。重要的是,研究者发现,热疗会激活肿瘤细胞MAPK通路,利于肿瘤细胞的生长,而这一通路可以被BRAF抑制剂逆转,表明BRAF抑制剂联合热疗是一种合理的治疗方案。

因此,研究者设计了一种光热响应的金纳米笼载药系统AuNC@mSiO2@copolymer∩vemurafenib (ASP∩V),联合光热疗和MAPK靶向治疗抑制肿瘤生长和促进肿瘤抗原递呈,同时结合PD-1抗体治疗黑色素瘤。该纳米系统由金纳米笼内核(可介导肿瘤光热疗)、载BRAF抑制剂vemurafenib的介孔二氧化硅壳层mSiO2(可抑制肿瘤生长)、表面包覆的热敏性聚合物pNIPAM-co-AM(调控药物可控释放)组成。通过对AuNC表面聚合物进行一系列的优化,使得该载药颗粒可以在肿瘤组织内富集,同时被肿瘤细胞内吞,而不被淋巴细胞内吞。制备的ASP∩V纳米颗粒表征良好,具有粒径小、近红外光(808 nm)刺激响应、肿瘤细胞内吞而淋巴细胞不内吞等特性。
纳米颗粒静脉注射后在肿瘤部位聚集,并被肿瘤细胞,而非淋巴细胞内吞。在近红外激光(808 nm)照射下,纳米颗粒将光能转化为热能,并在细胞内释放vemurafenib。Vemurafenib和光热协同诱导肿瘤细胞ICD的发生,释放肿瘤特异性新抗原和增强HSP蛋白的表达,促进肿瘤微环境T细胞的浸润。随后研究者在原发性黑色素瘤、远端肿瘤转移模型以及免疫“冷”肿瘤中研究了ASP∩V纳米系统的抗肿瘤作用及与anti-PD-1抗体的协同作用。研究者发现ASP∩V纳米系统介导的光热和BRAF靶向治疗可有效抑制肿瘤生长,促进肿瘤细胞ICD的发生和肿瘤微环境T细胞的浸润。而在光热靶向联合治疗的基础上,静脉注射anti-PD-1抗体不仅能抑制原发肿瘤的生长,还能通过激活系统性抗肿瘤免疫反应抑制远端肿瘤。更重要的是,该治疗方案可以有效地将免疫的“冷”肿瘤转化为“热”肿瘤,这将有利于缺乏肿瘤抗原特异性T细胞的免疫“冷”患者。
这一成果近期发表在Journal of Controlled Release杂志上,四川大学刘小伟博士、长春应用化学研究所冯艳林博士、复旦大学许杰教授为该论文的第一作者,四川大学石虎兵教授和长春应用化学研究所张海元教授为该论文的通讯作者。
Xiaowei Liu†, Yanlin Feng†, Jie Xu†, Ying Shi, Jiqiao Yang, Rongjie Zhang, Jinen Song, Xin Bai, Xi Wu, Yu Bao, Ya Luo, Huifang Li, Li Chai, Changyang Gong, Yan Wang, Bo Chen, Jianping Hu, Yan Fu, Yongzhang Luo, Haiyuan Zhang*, Hubing Shi*. Combination of MAPK inhibition with photothermal therapy synergistically augments the anti-tumor efficacy of immune checkpoint blockade. Journal of Controlled Release, 2021, 332, 194-209.
参考文献:
[1] Xiaowei. Liu, Yanlin. Feng, et al., MAPK-Targeted Drug Delivered by a pH-Sensitive MSNP Nanocarrier Synergizes with PD-1 Blockade in Melanoma without T-Cell Suppression, Advanced Functional Materials 29 (2019) 1806916.
[2] J. Schachter, A. Ribas, G.V. Long, et al. Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006), The Lancet 390(10105) (2017) 1853-1862.
[3] M. Holderfield, M.M. Deuker, et al. Targeting RAF kinases for cancer therapy: BRAF-mutated melanoma and beyond, Nature reviews. Cancer 14(7) (2014) 455-67.
[4] P.B. Chapman, A. Hauschild, et al.Improved survival with vemurafenib in melanoma with BRAF V600E mutation, The New England journal of medicine 364(26) (2011) 2507-16.
[5] G.V. Long, D. Stroyakovskiy, et al. Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma, The New England journal of medicine 371(20) (2014) 1877-88.
[6] C. Liu, W. Peng, et al.BRAF inhibition increases tumor infiltration by T cells and enhances the antitumor activity of adoptive immunotherapy in mice, Clinical cancer research : an official journal of the American Association for Cancer Research 19(2) (2013) 393-403.
[7] X. Jiang, J. Zhou, et al.The activation of MAPK in melanoma cells resistant to BRAF inhibition promotes PD-L1 expression that is reversible by MEK and PI3K inhibition, Clinical cancer research : an official journal of the American Association for Cancer Research 19(3) (2013) 598-609.
[8] R. Gutzmer, D. Stroyakovskiy, et al.Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced BRAF(V600) mutation-positive melanoma (IMspire150): primary analysis of the randomised, double-blind, placebo-controlled, phase 3 trial, Lancet (London, England) 395(10240) (2020) 1835-1844.
[9] M. Amini-Adle, N. Khanafer, et al.Thomas, Ineffective anti PD-1 therapy after BRAF inhibitor failure in advanced melanoma, BMC Cancer 18(1) (2018) 705.
供稿:刘小伟
编辑:余静