2021年8月3日,Journal of Investigative Dermatology杂志在线发表了题为“The Evolution of Acquired Resistance to BRAFV600E kinase inhibitor Is Sustained by IGF1-Driven Tumor Vascular Remodeling”的研究论文。研究发现黑色素瘤对BRAF抑制剂靶向治疗的耐药过程,伴随着血管的塌陷与重建,并且这种由IGF1介导的血管重塑过程促进了肿瘤耐药。
50-60%的恶性黑色素瘤发生BRAF突变,其中最常见的突变是BRAF V600E。目前已经有三种BRAF抑制剂(vemurafenib,dabrafenib以及encorafenib)被FDA批准用于临床治疗该类肿瘤。尽管一些病人在治疗早期疗效显著,症状明显缓解,但是由于原发性或获得性原因肿瘤很快发生耐药。关于BRAF抑制剂靶向治疗黑色素瘤耐药的机制主要集中于MAPK通路重激活及其他代偿通路激活。此外,肿瘤微环境在肿瘤耐药过程中也发挥着重要作用。比如,成纤维细胞,B细胞,巨噬细胞等可通过分泌细胞/趋化因子或生长因子促进肿瘤对BRAF抑制剂耐药。此外,作为肿瘤微环境的重要组成成分,肿瘤相关的新生血管不仅为肿瘤提供营养和氧气,还利于肿瘤转移。有文献报道,肿瘤新生血管形成也受肿瘤驱动基因影响。在多类肿瘤中,BRAF V600E突变的癌基因就可通过调控血管生成相关因子的表达从而促发血管新生,使用 BRAF 抑制剂可以阻断血管形成。然而,新生血管形成和黑色素瘤靶向治疗耐药的关系并未完全阐明,还有待于进一步研究。
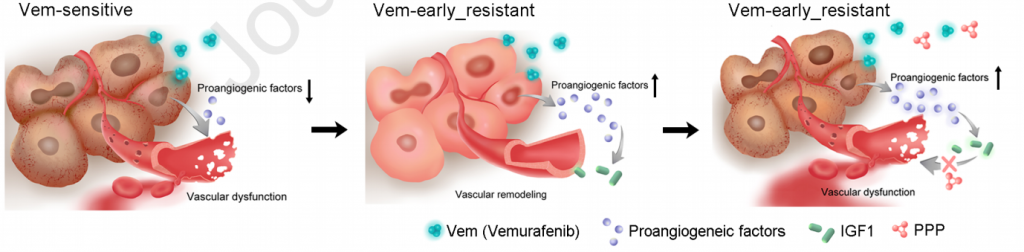
本课题组前期通过对黑色素靶向治疗前(baseline)、靶向治疗中(on-treatment)、靶向治疗后(disease progression)的转录组数据发掘发现,血管形成相关事件在肿瘤治疗响应早期和耐药早期显著富集,并通过构建小鼠模型验证这一发现。根据小鼠黑色素瘤对 BRAF 抑制剂响应的过程作者将整个治疗阶段分为4个时期:1)响应早期;2)休眠期;3)耐药早期;4)耐药稳定期。响应早期和休眠期肿瘤正常血管数量减少 ,管腔塌陷、破裂,而内皮细胞仍存在于组织中;耐药早期肿瘤内血管增多,管腔逐渐完整。血管形态以及相关转录组学的变化提示血管重塑参与了肿瘤耐药的发展。生信分析筛选出促血管形成分泌因子IGF1。 在小鼠黑色素瘤模型中,联合IGF1R磷酸化抑制剂和BRAF抑制剂能够干扰靶向治疗后期内皮细胞的血管形成能力,明显抑制肿瘤的生长。这一新靶点的发现与验证将为其他研究者及临床医生在黑色素瘤BRAF抑制剂靶向治疗耐药研究中提供新的解决方案。
四川大学生物治疗国家重点实验室博士后徐广超,研究生罗娅,博士后吴文爽,博士后刘小伟为本文共同第一作者,生物治疗国家重点实验室研究员石虎兵为本论文最后通讯作者。本工作得到了国家重点研发计划,国家自然科学基金项目以及四川省科学技术局重点项目等方面的支持与资助。
原文链接:https://doi.org/10.1016/j.jid.2021.07.162
供稿:罗娅
编辑:余静