乳腺癌在全球女性恶性肿瘤中发病率高居首位,且随着我国生活水平的提高,其发病率逐年递增。三阴性乳腺癌 (triple-negative breast cancer, TNBC) 是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)均为阴性的一类乳腺癌,约占所有乳腺癌的15%~20%(1-3)。与其他亚型相比,TNBC具有发病年龄早、侵袭性强、复发转移风险高等特征,且缺乏有效的治疗靶点,是目前预后最差的乳腺癌亚型,也是乳腺癌临床治疗中最棘手的难题之一。
有丝分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路是人类癌症中最常见的信号通路之一,其异常的激活与TNBC的不良预后高度相关,致使靶向MAPK通路被认为是治疗TNBC的前景策略(4-7)。然而,靶向该通路关键因子MEK的疗法却未能在TNBC的临床治疗上取得理想的效果。因此,阐明TNBC对MEK靶向治疗抗性的机制、寻找新的协同治疗靶点以改善TNBC患者的长期疗效将具有重要的临床意义。
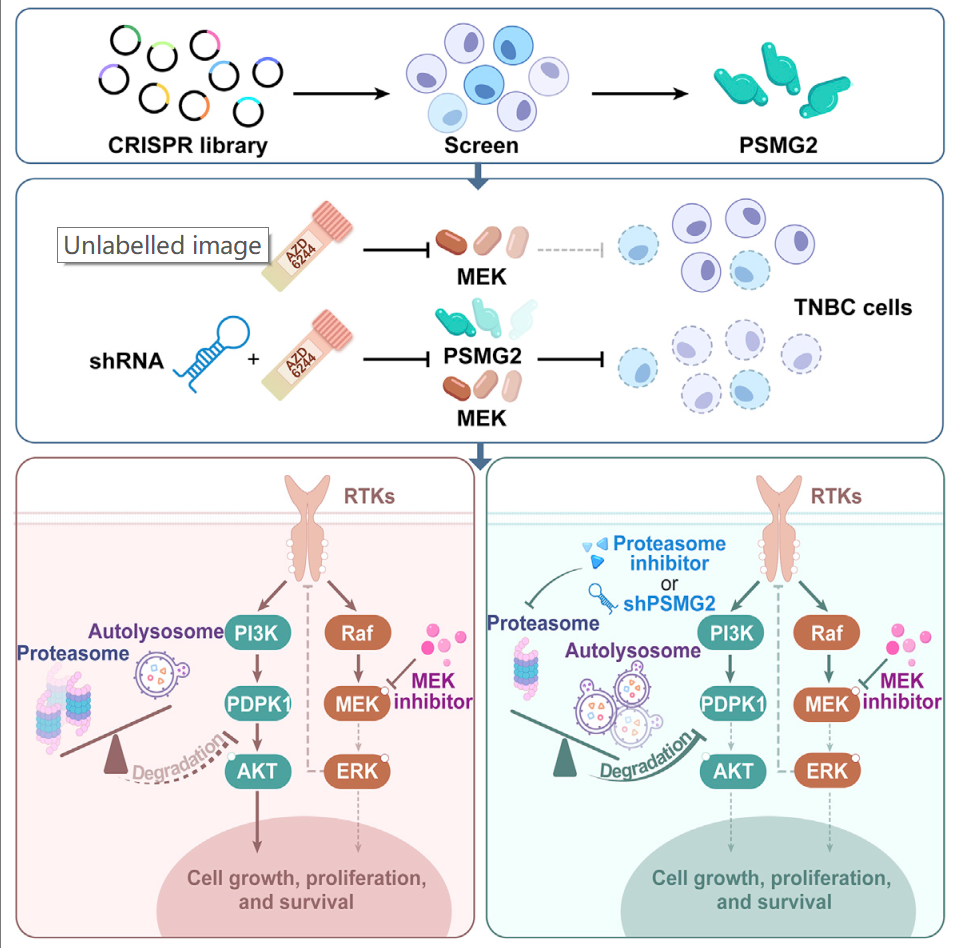
四川大学石虎兵和敬静领衔的研究团队基于TNBC患者MEK靶向治疗疗效不佳的这一临床问题,利用CRISPR/Cas9高通量筛选技术在MEKi耐药的TNBC细胞中进行全基因组范围内的无偏筛选,发现蛋白酶体组装伴侣2(PSMG2)是调节TNBC细胞对MEK抑制剂耐药的关键因子。体外实验表明,敲低PSMG2可通过损害蛋白酶体功能,增强MEK抑制剂对肿瘤细胞的生长抑制。研究者利用三阴性乳腺癌患者的临床样本群体测序数据和单细胞测序数据进行相关性分析,结果提示mTORC1通路与蛋白酶体呈高度正相关。进一步通过shRNA靶向敲低PSMG2或蛋白酶体抑制剂MG132抑制蛋白酶体,发现可以下调mTORC1通路中的PDPK1,抑制其下游p-AKT,进而协同MEK抑制剂抑制肿瘤细胞的生长。然而qPCR结果显示,抑制蛋白酶体后,PDPK1的转录和翻译均无明显变化,即抑制蛋白酶体不影响PDPK1的蛋白合成。
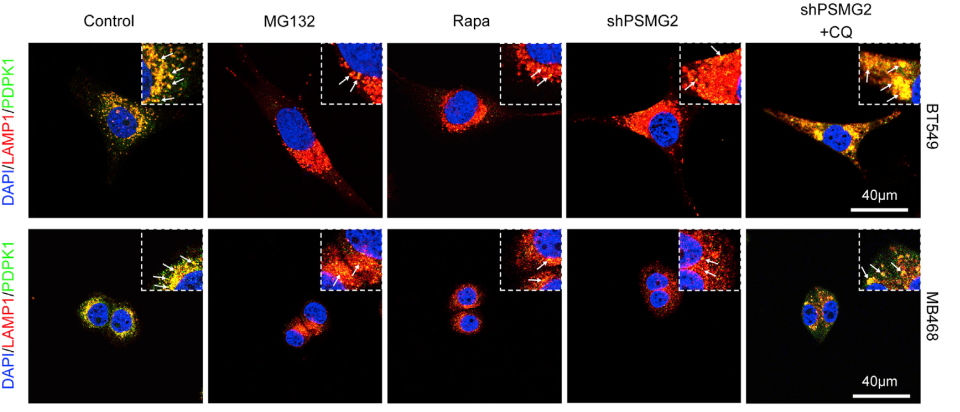
深入的机制研究发现,在PSMG2敲低或蛋白酶体被抑制情况下,PDPK1降解是由于自噬被激活。免疫荧光实验中,PDPK1和溶酶体膜蛋白LAMP1(溶酶体是自噬系统降解蛋白质的细胞器)共定位,提示PDPK1通过自噬途径降解。此外,在体外克隆形成实验中,自噬抑制剂氯喹可以部分逆转由蛋白酶体和MEK联合抑制介导的细胞生长抑制,也表明蛋白酶体抑制和MEK抑制剂对TNBC细胞的协同抑制效应由自噬介导的PDPK1降解驱动。最后,研究团队在TNBC细胞异种移植的小鼠模型中验证了联合靶向蛋白酶体(MG132)和MEK(AZD6244)的治疗效果,为临床治疗TNBC提出联合靶向蛋白酶体和MEK治疗TNBC的新思路。
这一成果近期发表在Cell旗下医学期刊Cell Reports Medicine,四川大学王学焱博士后、余静博士、刘小伟博士后为该论文的第一作者,四川大学石虎兵教授和敬静教授为该论文的通讯作者。
原文链接:
Xueyan Wang1*, Jing Yu1*, Xiaowei Liu1*, Dan Luo2, Yanchu Li3, Linlin Song4, Xian Jiang1, Xiaomeng Yin5, Yan Wang6, Li Chai6, Ting Luo1, Jing Jing1†, Hubing Shi1,7†. PSMG2-controlled proteasome-autophagy balance mediates the tolerance for MEK-targeted therapy in triple-negative breast cancer. Cell Rep Med. 2022 Sep 20;3(9):100741. doi: 10.1016/j.xcrm.2022.100741.
参考文献:
- Dent R, Trudeau M, Pritchard KI, Hanna WM, Kahn HK, Sawka CA, et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res. 2007;13(15 Pt 1):4429-34.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin. 2019;69(1):7-34.
- Aysola K, Desai A, Welch C, Xu J, Qin Y, Reddy V, et al. Triple Negative Breast Cancer – An Overview. Hereditary Genet. 2013;2013(Suppl 2).
- Eralp Y, Derin D, Ozluk Y, Yavuz E, Guney N, Saip P, et al. MAPK overexpression is associated with anthracycline resistance and increased risk for recurrence in patients with triple-negative breast cancer. Annals of Oncology. 2008;19(4):669-74.
- Loi S, Dushyanthen S, Beavis PA, Salgado R, Denkert C, Savas P, et al. RAS/MAPK Activation Is Associated with Reduced Tumor-Infiltrating Lymphocytes in Triple-Negative Breast Cancer: Therapeutic Cooperation Between MEK and PD-1/PD-L1 Immune Checkpoint Inhibitors. Clinical Cancer Research. 2016;22(6):1499-509.
- Brufsky A, Kim SB, Zvirbule Z, Eniu A, Mebis J, Sohn JH, et al. A phase II randomized trial of cobimetinib plus chemotherapy, with or without atezolizumab, as first-line treatment for patients with locally advanced or metastatic triple-negative breast cancer (COLET): primary analysis. Annals of Oncology. 2021;32(5):652-60.
- Adeyinka A, Nui Y, Cherlet T, Snell L, Watson PH, Murphy LC. Activated mitogen-activated protein kinase expression during human breast tumorigenesis and breast cancer progression. Clin Cancer Res. 2002;8(6):1747-53.
供稿:王学焱
编辑:宋金恩