免疫检查点阻断剂(ICB)在包括黑色素瘤、肺癌等多种恶性疾病中显现出持续的抗肿瘤效果,且毒性反应轻,在临床上得到广泛的应用[3]。然而ICB单独用于治疗TNBC疗效不佳[1, 3]。尽管通过一些联合治疗手段能够使ICB药物的疗效得到提升[2, 4-6],但联合治疗方案更严重的生物毒性在很大程度上限制了临床常规应用,是的ICB用于TNBC治疗的研究发展缓慢。寻求改善ICB在TNBC中低响应性的方法对于改善TNBC的预后意义重大。
2022年11月4日,四川大学华西医院乳腺疾病临床研究中心石虎兵教授团队在Nano Today发表了题为“Improvement of radiotherapy with an ozone-carried liposome nano- system for synergizing cancer immune checkpoint blockade”的研究。该研究首次将臭氧作为活性氧自由基(Reactive oxygen species, ROS)供体,构建了可用于体内肿瘤治疗的臭氧脂质体纳米递送系统。该系统能够稳定地向肿瘤组织靶向递送臭氧,在X射线的触发下臭氧迅速产生大量羟基自由基(其效率远高于氧气),促进肿瘤细胞发生免疫原性死亡,并释放肿瘤相关抗原,激活以T细胞为基础的抗肿瘤免疫,从而显著改善免疫检测点抑制剂对三阴性乳腺癌的抗肿瘤效果。

研究者首先通过超声乳化法制备了全氟萘烷乳液,并利用全氟萘烷强大的气体吸附能力吸附臭氧。同时通过薄膜分散法制备了磷脂双层载体,包裹载臭氧的全氟萘烷纳米乳,形成载臭氧全氟萘烷纳米脂质体。该纳米脂质体能够在常规条件下稳定保存14天以上,且具有强大的臭氧吸附能力。随后研究者将O3_PFD@Liposome经尾静脉注射到TNBC肿瘤细胞荷瘤小鼠体内。注射后,O3_PFD@Liposome积聚在肿瘤组织中并被肿瘤细胞内化。在X射线的照射下,臭氧被电离产生羟基自由基并分解成氧气,分别诱发ROS效应和缓解缺氧。利用在这两种效应的共同作用,本研究获得的臭氧纳米脂质体可以协同提高放疗效率,同时调节肿瘤免疫微环境,提高PD-1单抗对免疫抑制肿瘤的疗效。
随后,作者进一步评估了O3_PFD@Liposome在体外及体内对三阴性乳腺癌的抗肿瘤效应,证实O3_PFD@Liposome经血液循环到达肿瘤后被肿瘤细胞内吞,与X射线协同发挥三阴乳腺癌细胞杀伤效果,上调肿瘤免疫原性细胞死亡水平,并诱导CD4+和CD8+ T细胞浸润,激活抗肿瘤免疫反应。
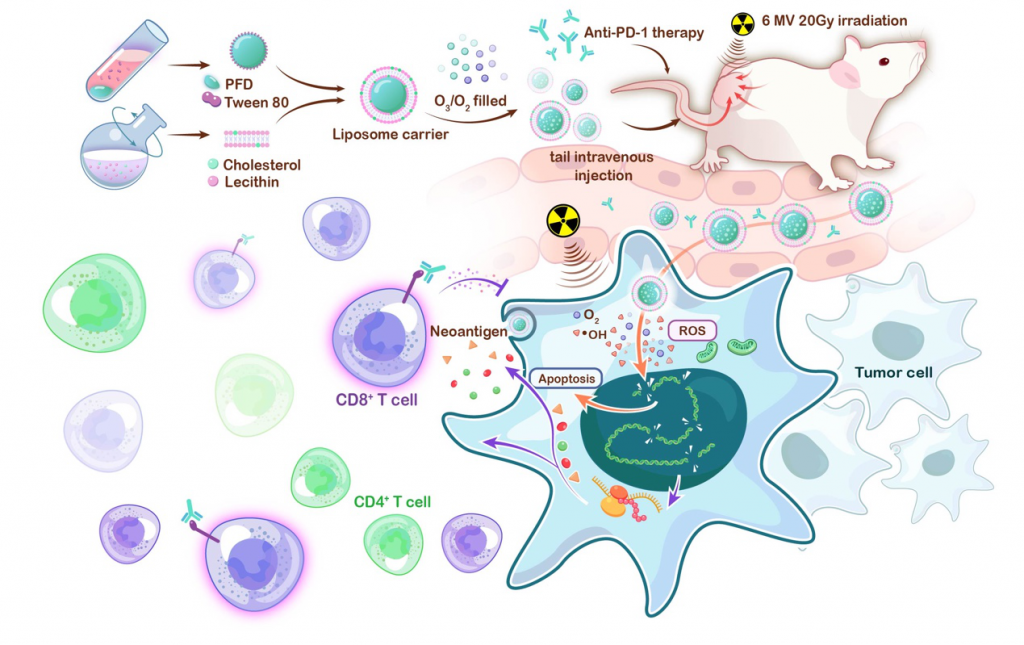
在上述工作基础上,研究者进一步评估了O3_PFD@Liposome联合X线放疗和PD-1单抗对于远隔部位肿瘤的生长抑制作用。研究证实相比于单独使用PD-1单抗或PD-1单抗联合放疗,O3_PFD@Liposome联合X线放疗通过大量产生羟基自由基,显著促进原发及远隔部位肿瘤免疫原性细胞死亡,并进一步上调肿瘤微环境中CD4+和CD8+ T细胞浸润水平。O3_PFD@Liposome联合放疗在原发及远隔部位肿瘤中都显示出与PD-1单抗良好的协同抗肿瘤作用。
文章结论与展望
本研究首次构建了安全有效的体内臭氧纳米脂质体递送系统,并与X射线放疗联合显著改善了三阴乳腺癌免疫抑制微环境,最终成功提高了PD-1单抗在三阴性乳腺癌中的抗肿瘤效果。臭氧是理想的氧供体,但由于其极强的氧化性和不稳定性阻碍了体内应用研究的开展。该项研究首次实现了利用臭氧在体内达到可控治疗和免疫调节的目的,意义重大,为团队进一步围绕以臭氧为核心的多种纳米级诊疗材料及技术奠定了基础。该成果该研究成果所涉及的臭氧载体材料组分均被批准用于临床,安全性高,有望经进一步优化后在未来实现临床转化。
参考文献:
[1] Adams, S., et al. Pembrolizumab monotherapy for previously treated metastatic triple-negative breast cancer: cohort A of the phase II KEYNOTE-086 study. Ann Oncol 30, 397-404 (2019).
[2] Jia, H., et al. Immunotherapy for triple-negative breast cancer: Existing challenges and exciting prospects. Drug Resist Updat 32, 1-15 (2017).
[3] Keenan, T.E., and Tolaney, S.M. Role of Immunotherapy in Triple-Negative Breast Cancer. J Natl Compr Canc Netw 18, 479-489 (2020).
[4] Ramjiawan, R.R., et al. Anti-angiogenesis for cancer revisited: Is there a role for combinations with immunotherapy? Angiogenesis 20, 185-204 (2017).
[5] Schmid, P., et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med 379, 2108-2121 (2018).
[6] Yi, M., et al. Synergistic effect of immune checkpoint blockade and anti-angiogenesis in cancer treatment. Mol Cancer 18, 60 (2019).
供稿:郑 丹
编辑:宋金恩