肿瘤细胞的转移扩散是癌症相关死亡的主要原因。从原发灶肿瘤脱落的循环肿瘤细胞(Circulating tumor cells, CTCs)被认为是肿瘤远端转移的“种子”1-3。阐明肿瘤细胞转移扩散的潜在机制,开发针对肿瘤转移“种子”细胞的新型治疗策略对抑制肿瘤转移具有重要意义。近年来,随着人们对肿瘤免疫逃逸的认知,免疫检查点阻断已经彻底改变了多种癌症的治疗模式4-6。目前,实体肿瘤原发或转移灶肿瘤微环境中肿瘤细胞与不同类型的免疫细胞之间的免疫检查点分子已经得到了广泛的研究。由于血液循环是肿瘤细胞从原发灶向远端转移的主要途径7-9,研究CTCs与血液中免疫细胞之间的相互作用可能提供一种通过激活宿主免疫系统来阻断转移的策略。然而,目前关于CTCs在血液中如何逃脱宿主免疫监视的机制尚不清楚,也缺乏有效的抑制CTCs转移扩散的治疗方案。
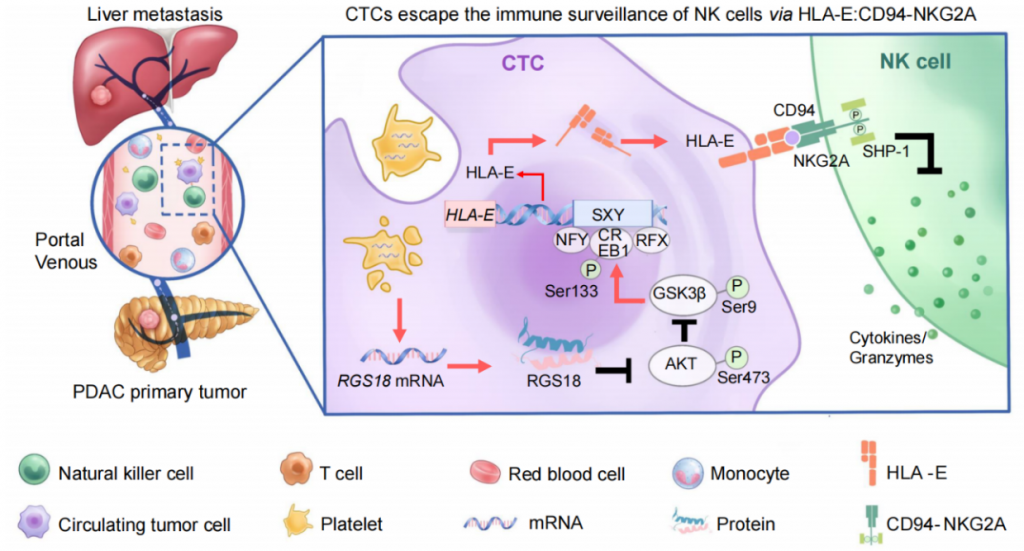
2023年1月26日,四川大学华西医院生物治疗国家重点实验室石虎兵教授团队联合四川大学华西医院马学磊副教授在Cancer Cell发表封面研究论文Immune checkpoint HLA-E:CD94-NKG2A mediates evasion of circulating tumor cells from NK cell surveillance,发现了CTCs与NK细胞间新的免疫检查点分子对HLA-E:CD94-NKG2A,阐明了CTCs逃避宿主免疫监视的新机制,进而提出靶向免疫检查点HLA-E:CD94-NKG2A抑制肿瘤转移的治疗策略。

封面设计灵感来源于中国古典四大名著之一的《西游记》。当孙悟空(NKs)识破美丽的小女孩是由一心想吃唐僧肉的白骨精(CTCs)所变,并要尝试将其杀死时,白骨精会通过假装楚楚可怜唤起唐僧(血小板)的悲悯之心来保护她,猪八戒(HLA-E)也被唐僧误导,以致最后阻碍了对白骨精的制服(图2)。

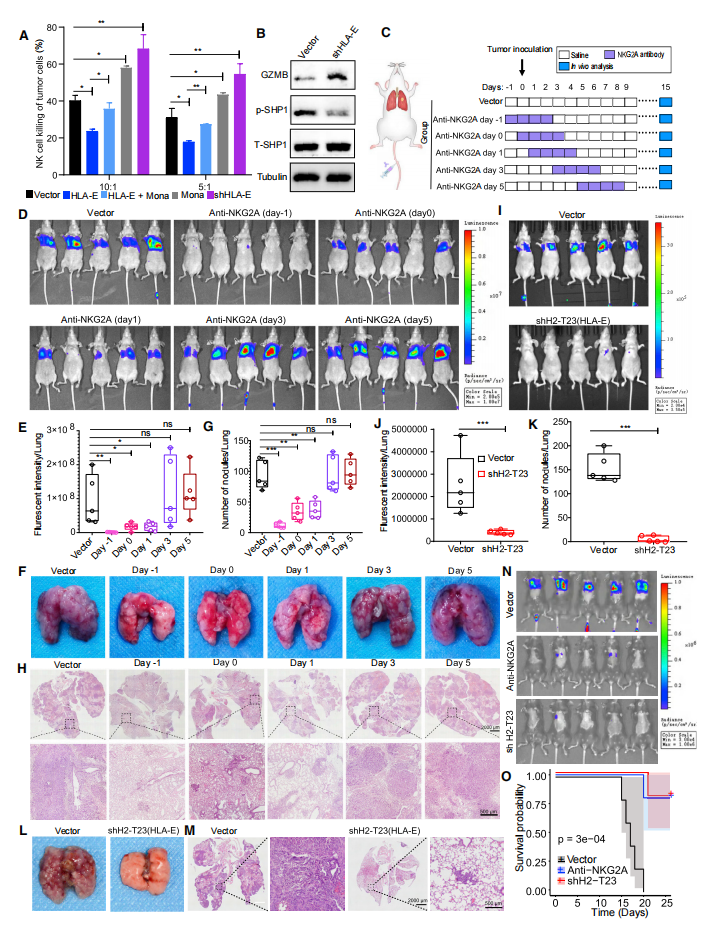
为了研究CTCs的转移机制,团队以胰腺导管癌(pancreatic ductal adenocarcinoma, PDAC)肝转移为模型,利用单细胞转录组测序技术刻画了PDAC原发灶肿瘤、CTCs和肝转移灶肿瘤微环境的转录普特征,基于CellPhoneDB分析了原发灶肿瘤细胞、CTCs和转移灶肿瘤细胞与免疫细胞间的相互作用,鉴定出CTCs与NK细胞间特异性的免疫检查点分子对HLA-E:CD94-NKG2A(图3)。并通过体内外实验,证明了利用anti-NKG2A的阻断抗体或者shHLA-E阻断该免疫检查点分子对的结合可有效的抑制肿瘤转移(图4),表明HLA-E:CD94-NKG2A是CTCs与NK细胞间的一个新型的免疫检查点分子对。

进一步的分子机制研究发现,血小板来源RGS18通过AKT-GSK3β-CREB信号通路驱动CTCs中HLA-E的表达上调。有趣的是,该研究发现CTCs可以内吞血小板,并获得RGS18基因,从而帮助CTCs逃避NK细胞的免疫监视(图5,视频1)。这一发现颠覆了以往人们认为血小板黏附在CTC表面保护CTCs的认知10-12,为研究血小板促进肿瘤转移提供了新的思路。
视频1. 肿瘤细胞吞噬血小板 (红色为血小板)
文章结论与讨论,启发与展望
综上所述,本研究发现了CTCs与NK细胞间新的免疫检查点分子HLA-E:CD94-NKG2A,阻断该免疫检查点可抑制肿瘤重要。揭示了CTCs通过血小板来源的RGS18上调免疫检查点HLA-E逃避宿主免疫监视的新机制,为治疗肿瘤转移提供了新的靶点和思路。此外,本研究发现血小板可以被CTCs内吞,帮助其逃避免疫监视,为研究血小板介导肿瘤转移提供了新的思路。但本研究中关于CTCs是否还受其他免疫细胞的监视,以及是否存在其他免疫检查点,仍需要更多的研究工作去探索。
四川大学华西医院刘小伟助理研究员、四川大学生物治疗国家重点实验室博士研究生宋金恩、刘馨雨和四川大学华西医院张浩副教授为文章的共同第一作者,四川大学生物治疗国家重点实验室石虎兵教授和四川大学华西医院生物治疗科马学磊副教授为通讯作者。
参考文献:
- Mohme, M., Riethdorf, S., and Pantel, K. (2017). Circulating and disseminated tumour cells – mechanisms of immune surveillance and escape. Nature reviews. Clinical oncology 14, 155-167. 10.1038/nrclinonc.2016.144.
- Yu, M. (2019). Metastasis Stemming from Circulating Tumor Cell Clusters. Trends in cell biology 29, 275-276. 10.1016/j.tcb.2019.02.001.
- Deng, Z., Wu, S., Wang, Y., and Shi, D. (2022). Circulating tumor cell isolation for cancer diagnosis and prognosis. EBioMedicine 83, 104237. 10.1016/j.ebiom.2022.104237.
- Tang, J., Yu, J.X., Hubbard-Lucey, V.M., Neftelinov, S.T., Hodge, J.P., and Lin, Y. (2018). Trial watch: The clinical trial landscape for PD1/PDL1 immune checkpoint inhibitors. Nature reviews. Drug discovery 17, 854-855. 10.1038/nrd.2018.210.
- Sanmamed, M.F., and Chen, L. (2018). A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization. Cell 175, 313-326. 10.1016/j.cell.2018.09.035.
- Twomey, J.D., and Zhang, B. (2021). Cancer Immunotherapy Update: FDA-Approved Checkpoint Inhibitors and Companion Diagnostics. The AAPS journal 23, 39. 10.1208/s12248-021-00574-0.
- Lambert, A.W., Pattabiraman, D.R., and Weinberg, R.A. (2017). Emerging Biological Principles of Metastasis. Cell 168, 670-691. 10.1016/j.cell.2016.11.037.
- Plaks, V., Koopman, C.D., and Werb, Z. (2013). Cancer. Circulating tumor cells. Science (New York, N.Y.) 341, 1186-1188. 10.1126/science.1235226.
- Ganesh, K., and Massagué, J. (2021). Targeting metastatic cancer. Nature medicine 27, 34-44. 10.1038/s41591-020-01195-4.
- Ward, M.P., L, E.K., L, A.N., Mohamed, B.M., Kelly, T., Bates, M., Clarke, A., Brady, N., Martin, C.M., Brooks, R.D., et al. (2021). Platelets, immune cells and the coagulation cascade; friend or foe of the circulating tumour cell? Molecular cancer 20, 59. 10.1186/s12943-021-01347-1.
- Gay, L.J., and Felding-Habermann, B. (2011). Contribution of platelets to tumour metastasis. Nature reviews. Cancer 11, 123-134. 10.1038/nrc3004.
- Labelle, M., and Hynes, R.O. (2012). The initial hours of metastasis: the importance of cooperative host-tumor cell interactions during hematogenous dissemination. Cancer discovery 2, 1091-1099. 10.1158/2159-8290.Cd-12-0329.
供稿:刘小伟
编辑:宋金恩